Dưới đó là bài viết tổng hợp triết lý hóa cơ học 12 do kiến Guru biên soạn nhằm giúp các bạn củng núm và tổng hợp lại các kiến thức về lý thuyết hóa hữu phòng ban trọng. Bài viết gồm 2 phần hợp chất hữu cơ, định nghĩa và đối chiếu nguyên tố. Hy vọng rằng bài viết sẽ góp cho chúng ta ôn tập trong kì thi sắp tới. Bọn họ cùng nhau học nhé!
I. Tổng hợp lý thuyết hóa hữu cơ 12: Hợp chất hữu cơ với hóa học hữu cơ
1. Kim chỉ nan hóa cơ học : khái niệm
- Hợp chất hữu cơ là hòa hợp chất của các hợp hóa học của C trừ oxit của C, muối cacbua, muối hạt cacbonat với muối xianua.
Bạn đang xem: Tóm tắt lý thuyết hóa hữu cơ 12
- Hoá học tập hữu cơ là ngành chất hóa học chuyên nghiên cứu các hợp hóa học hữu cơ.
2. Phân loại hợp chất hữu cơ.
Hợp chất hữu cơ đang được phân tách thành hidrcacbon và dẫn xuất các hidrcacbon.
a. Hidrcacbon là loại hợp chất hữu cơ đơn giản nhất, vào thành phần phân tử chỉ chứa hai nguyên tố là cacbon và hidro.
- Hidrocacbon mạch hở:
+ Hidrocacbon no: Ankan CH4
+ Hidrocacbon ko no có một nối đôi: Anken C2H4
+ Hidrcacbon không no sẽ có hai nối đôi: Ankadien
- Hidrocacbon mạch vòng:
+ Hidrocacbon no: xicloankan
+ Hidrocacbon mạch vòng: Aren
b. Dẫn xuất của hidrocacbon là những hợp chất mà vào phân tử ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen...
- Dẫn xuất halogen: R – X ( R là gốc hidrocacbon)
- Hợp chất chứa nhóm chức:
- OH - : ancol; - O - : ete; - COOH: axit......
3. Đặc điểm chung
- Hợp hóa học hữu cơ độc nhất vô nhị thiết phải chứa C, hay có H thường chạm mặt O ngoài ra còn bao gồm halogen, N, P...
- liên kết chủ yếu trong hợp chất hữu cơ là links cộng hóa trị.
- các hợp chất hữu cơ thường dễ bay hơi, dễ dàng cháy, yếu bền nhiệt.
- các phản ứng trong hoá học tập hữu cơ hay chậm, không trả toàn, xảy ra theo rất nhiều hướng thường cần đun rét và bao gồm xúc tác.
4. Các cách thức tinh chế hợp hóa học hữu cơ
- bác bỏ cất: nhằm để tách bóc các chất lỏng cùng có nhiệt độ sôi không giống nhau nhiều.
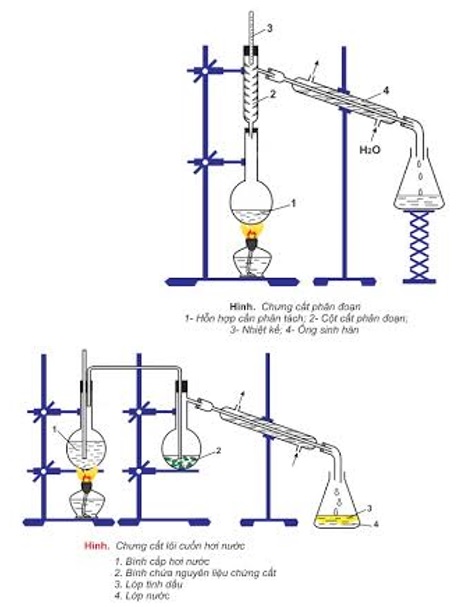
- Chiết: là để tách hai chất lỏng không xáo trộn vào nhau.
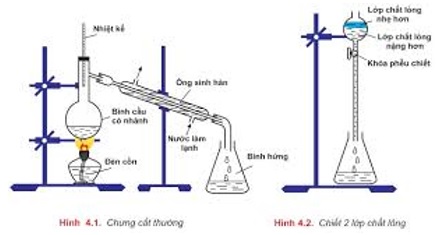
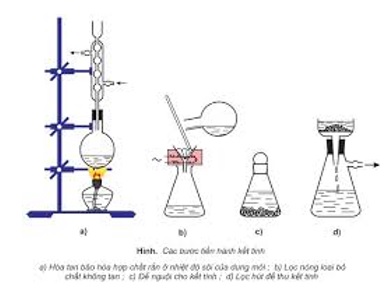
- Kết tinh lại: để tách bóc các chất rắn tất cả độ tan khác nhau theo nhiệt độ độ.
II. Tổng hợp định hướng hóa hữu cơ 12: phân tích nguyên tố
Để xác định công thức phân tử hợp chất hữu cơ người ta phải xác định :
- Thành phần định tính nguyên tố.
- Thành phần định lượng nguyên tố.
- Xác định khối lượng phân tử.
1. Phân tích định tính nguyên tố.
- Phân tích định tính nguyên tố để xác định thành phần các nguyên tố hóa học chứa trong một chất.
- Muốn xác định thành phần các nguyên tố , người ta chuyển các nguyên tồ trong hợp chất hữu cơ thành các hợp chất vô cơ đơn giản rồi nhận ra các sản phẩm đó.
a. Xác định cacbon và hidro.
- Hoặc có thể dùng chất hút nước mạnh như : H2SO4 đđ, Ca
Cl2khan, P2O5.
b. Xác định nitơ và oxi.
- Nhận N: Đốt cháy hợp chất hữu cơ, nếu có mùi khét thì hợp chất đó có nitơ.
Hoặc đun hợp chất hữu cơ với H2SO4đặc ( Na
OH đặc) có mùi khai NH3thì hợp chất đó có chứa nitơ.
- Nhận O : Khó phân tích định tính trực tiếp, thường xác định nhờ định lượng:
m
O = mhợp chất – tổng khối lượng các nguyên tố
c. Xác định halogen.
Khi đốt cháy hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl, ta dùng dung dịch Ag
NO3
HCl + Ag
NO3→ Ag
Cl↓ + HNO3
2. Phân tích định lượng các nguyên tố:
- Phân tích định lượng các nguyên tố xác định khối lượng của mỗi nguyên tố hóa học chứa trong hợp chất hữu cơ.
- Muốn định lượng nguyên tố, người ta chuyển các nguyên tố vào hợp chất hữu cơ thành các hợp chất vô cơ đối kháng giản, định lượng chúng, từ đó suy ra khối lượng từng nguyên tố có trong một chất.
a. Định lượng cacbon và hidro.
VD: Đốt cháy chất hữu cơ A thu được CO2 và H2O và N2
m
C (A)= m
C(CO2)= n
CO2.12
m
H(A)= m
H(H2O)= n
H2O.2
b. Định lượng nitơ
m
N(A) = n
N2.28
c. Định lượng oxi
m
O= m(A)– ( m
C+ m
H+ m
N).
* Chú ý :
- Dùng H2SO4đặc, P2O5, Ca
Cl2khan hấp thụ H2O.
- Dùng Na
OH, KOH, Ca(OH)2hấp thụ CO2, độ tăng khối lượng của bình xuất xắc khối lượng kết tủa Ca
CO3giúp ta tính được CO2
- Chỉ dùng Ca
O, Ca(OH)2, Na
OH hấp thụ sản phẩm gồm CO2 và H2O thì khối lượng bình tăng chính là tổng khối lượng CO2 và H2O.
3. Thành phần nguyên tố:
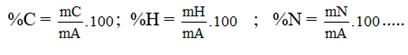
Bài viết tổng hợp kim chỉ nan hóa cơ học 12 nhằm giúp các bạn tổng hợp các kiến thức cơ bản, giúp những bạn bổ sung những lỗ hổng kiến thức và kỹ năng của phiên bản thân tương tự như giúp chúng ta có thêm tài liệu tốt để tìm hiểu thêm và học tập. Phần hữu cơ là phần rất đặc biệt quan trọng trong kì thi trung học diện tích lớn quốc gia, đó là phần mang điểm tự 5-7 điểm . Mong muốn rằng qua nội dung bài viết này, loài kiến Guru đang giúp các bạn ôn luyện cùng thi tốt! Chúc các bạn thành công!
Lý thú nhưng đầy thử thách – Hóa học là một trong môn nhưng mà để đạt điểm cao trong kỳ thi THPT quốc gia đòi hỏi học viên cần ghi nhớ định hướng hóa 12 một biện pháp chắc chắn, đồng thời nuốm vững các dạng bài bác tập theo từng chuyên đề. Tổng hợp kim chỉ nan hóa học tập 12 vô cơ và hữu cơ một cách chi tiết và khá đầy đủ sẽ là chìa khóa giúp cho bạn công phá môn học này. Hãy cùng cdvhnghean.edu.vn nắm tắt triết lý hóa 12 qua nội dung nội dung bài viết dưới đây!
Tổng hợp định hướng hóa học tập 12 ôn thi đại học
Kiến thức về triết lý Este
Kiến thức về định hướng Lipit
Ôn tập kim chỉ nan hóa 12: Cacbohiđrat
Kiến thức về định hướng Glucozơ
Tóm tắt kim chỉ nan hóa 12 chương 4: Polime và vật liệu polime
Tổng hợp kiến thức hóa học 12: Đại cương cứng về kim loại
Vị trí sắt kẽm kim loại trong bảng tuần hoàn và kết cấu của kim loại
Tính chất của kim loại – hàng điện hóa của kim loại
Sự ăn mòn kim loại
Phương pháp pha chế kim loại
Nhận biết một số trong những chất khí vào dung dịch
Tóm tắt kim chỉ nan hóa 12: Hóa học và vấn đề phát triển kinh tế
Tổng hợp lý thuyết hóa học tập 12 ôn thi đại học
Trong kỳ thi thpt Quốc gia, kỹ năng và kiến thức chủ yếu hèn là chất hóa học 12. Mặc dù nhiên, học viên cũng cần ôn tập khá đầy đủ phần kiến thức hóa lớp 10 và 11. Với giữa trung tâm ôn thi, dưới đó là những văn bản tổng hợp triết lý hóa 12 mà học sinh cần chú ý khi ôn tập.
Kiến thức về định hướng Este
Khái niệm về EsteNếu ta cầm cố nhóm OH ở team cacboxyl của axit cacboxylic bằng nhóm OR’ thì ta sẽ tiến hành este.
Với este đối kháng chức RCOOR’, thì trong số ấy R là cội hidrocacbon tốt H; R’ là cội hidrocacbon.
Ta sẽ có được Este no solo chức mạch hở: Cn
H2n
O2 (với n≥2)
Tên cội R’ ( cội ankyl ) + tên nơi bắt đầu axit RCOO (đuôi at)
Ví dụ: CH3COOC2H5: Etyl axetat
CH2=CH−COOCH3: Metyl acrylat
CH3COOCH2C6H5: benzylaxetat

Tính chất vật lý của Este
Este được nghe biết là có ánh sáng sôi, độ tan trong nước thấp rộng axit với ancol bao gồm cùng số cacbon : axit > ancol > este.
Mùi đặc trưng của Este: Isoamyl axetat sẽ có mùi chuối chín hay Etyl butiat, etyl propionat lại có mùi dứa.
Tính chất hóa học của EsteEste khi thủy phân trong môi trường thiên nhiên axit tạo nên 2 lớp hóa học lỏng với là bội phản ứng thuận nghịch (2 chiều).
RCOOR′+H2O→RCOOH+R′OHNgược lại, Este lúc thủy phân trong môi trường kiềm (Phản ứng xà chống hóa) lại à phản bội ứng 1 chiều
RCOOR′+NaOH→RCOONa+R′OH
Este đốt cháy sinh sản thành CO2 cùng H2O ví như este là este no đối kháng chức và mạch hở (Cn
H2n
O2)
Este xuất hiện thêm phản ứng tráng bạc.
Cách điều chế EsteAxit+Ancol⇌Este+H2O
RCOOH+R′OH⇌RCOOR′+H2O
Kiến thức về định hướng Lipit
Khái niệm về LipitLipit theo luồng thông tin có sẵn đến đó là những hợp hóa học hữu cơ bao gồm trong tế bào sống. Lipit vốn không tổ hợp trong nước nhưng lại lại tan các trong dung môi hữu cơ không phân cực.
Chất mập là trieste của glixerol cùng với axit khủng được gọi chung là triglixerit giỏi triaxylglixerol.
Công thức tầm thường Lipit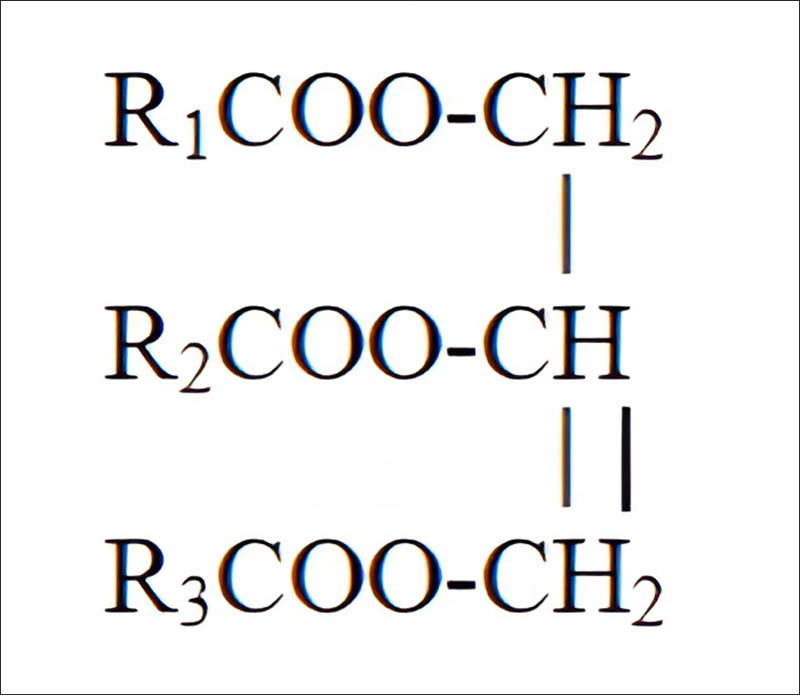
R1,R2,R3: là nơi bắt đầu hidrocacbon giống hoặc khác nhau
Ví dụ:
(C17H35COO)3C3H5: tristearoylglixerol (tristearin): Chất bự no (chất rắn)
Tính chất vật lí của LipitỞ ánh nắng mặt trời thường, chất phệ ở tinh thần lỏng lúc trong phân tử gồm gốc hidrocacbon không no. Ở tâm lý rắn khi trong phân tử có gốc hidrocacbon no.
Chất béo không tung trong nước, nhẹ hơn nước.
Tính hóa chất của LipitPhản ứng thủy phân của Lipit
(C17H35COO)3C3H5+3H2O→C17H35COOH+C3H5(OH)3Phản ứng xà chống hóa của Lipit: muối hạt của axit to (xà phòng) cùng glixerol
(C17H35COO)3C3H5+3NaOH→3C17H35COONa+C3H5(OH)3
Phản ứng cộng hidro của chất lớn lỏng thành chất to rắn (bơ nhân tạo)
(C17H33COO)3C3H5+3H2→(C17H35COO)3C3H5Ôn tập kim chỉ nan hóa 12: Cacbohiđrat
Cacbohiđrat được nghe biết là số đông hợp chất hữu cơ tạp chức và thường sẽ có CTCT hóa học như sau: Cn(H2O)m
Cacbohidrat hay được chia làm 3 loại hầu hết dưới đây:
Đisaccarit chính là nhóm mà lại khi thủy phân mỗi phân tử sẽ có mặt 2 phân tử monosaccarit.Polisaccarit là nhóm nhưng mà khi ta thủy phân mang đến cùng từng phân tử thì đã sinh ra những phân tử monosaccarit.Kiến thức về kim chỉ nan Glucozơ
Tính hóa học vật lý của GlucozơTrong huyết người sẽ sở hữu nồng độ glucozơ không đổi khoảng 0,1%Cấu chế tác phân tử của Glucozơ
Glucozơ tất cả CTPT hóa học: C6H12O6Glucozơ gồm CTCT: CH2OH−CHOH−CHOH−CHOH−CHOH−CH=O hoặc CH2OH
Tính hóa học của ancol nhiều chức:
Tác dụng với Cu(OH)2: Ở ánh nắng mặt trời sẽ thường tạo ra phức đồng glucozơ (dung dịch màu xanh da trời lam phân biệt glucozơ).
Phản ứng tạo este: tạo thành este cất 5 nơi bắt đầu axit.
Tính hóa học của andehit:
Oxi hóa glucozơ bằng dung dịch Ag
NO3 ta có:
NO3+2NH3+H2O→HOCH2
Khử glucozơ bằng H2 để tạo ra thành sobitol
C6H12O6+H2→C6H14O6Phản ứng lên men như sau:
C6H12O6→2C2H5OH+2CO2Kiến thức về triết lý Fructozơ
Công thức cấu trúc của Fructozơ:
C6H12O6 : Đồng phân của glucozơ
CTCT mạch hở Fructozơ như sau: CH2OH−CHOH−CHOH−CHOH−CO−CH2OH
Tính chất ancol đa chức (phản ứng Cu(OH)2 ở ánh nắng mặt trời thường tạo nên dd xanh lam nhận biết).
Fructozơ ⇌ GlucozơTrong môi trường thiên nhiên bazơ fructozơ chuyển thành glucozơ → fructozơ bị oxi hóa bởi vì Ag
NO3/NH3 cùng Cu(OH)2 trong môi trường kiềm tựa như glucozơ.
Kiến thức về Saccarozơ (đường mía)
Saccarozơ chính là một nơi bắt đầu glucozơ cùng rất một gốc fructozơ links qua O.
Saccarozơ thâm nhập phản ứng thủy phân (có axit H+ xúc tác) và tính năng Cu(OH)2 (tạo dung dịch màu xanh da trời lam)
2C12H22O11+Cu(OH)2→(C12H21O11)2Cu+2H2OKiến thức về Mantozơ (đường mạch nha)
Mantozơ thực tế sẽ bao hàm 2 cội glucozơ để tạo ra thành.
Mantozơ gia nhập phản ứng thủy phân (có axit H+ xúc tác)
C12H22O11+H2O→2C6H12O6Tính hóa học của mantozơ cũng như như với glucozơ.
Kiến thức về lý thuyết Tinh bột
Tinh bột đó là hỗn đúng theo của amilozo và amilopectin.
Tinh bột vì chưng alpha glucozo sản xuất thành
Tinh bột gia nhập phản ứng thủy phân (có axit H+ xúc tác)
(C6H10O5)n+nH2O→n
C6H12O6
Kiến thức về kim chỉ nan Xenlulozơ
Xenlulozo vì chưng beta glucozo tạo thành thành và gồm 3 team OH- từ do
Xenlulozo tham gia phản ứng thủy phân (có axit H+ xúc tác)
(C6H10O5)n+nH2O→n
C6H12O6
Tóm tắt kim chỉ nan hóa 12 chương 4: Polime và vật tư polime
Khái niệm về Polime
Polyme được nghe biết là phần nhiều hợp chất bao gồm phân tử khối không nhỏ do nhiều đơn vị cơ sở (gọi là đôi mắt xích) liên kết với nhau để tạo ra nên.
Cách phân một số loại Polime
Theo mối cung cấp gốc
Polime tổng hợp.Polime thiên nhiên.Polime chào bán tổng hợp.Theo bí quyết tổng hợp
Polime trùng hợp.Polime trùng ngưng.Theo điểm sáng cấu trúc
Polime mạch ko phân nhánh.Polime mạch phân nhánh.Polime mạng ko gian.Tính hóa học vật lý của Polime
Hầu không còn là chất rắn, không phai hơi, không tồn tại nhiệt độ nóng chảy xác địnhKhông tan trong những dung môi thông thường
Một số có tính dẻo, một trong những có tính bọn hồi, một số hoàn toàn có thể kéo sợi
Phương pháp điều chế Polime
Phản ứng trùng hợp
Quá trình cùng hợp liên tục nhiều phân tử nhỏ dại (monome) như là nhau hay tương tự nhau thành phân tử to (polime) .
Điều kiện: Monome có links bội hoặc vòng kém bền.
Phản ứng trùng ngưng
Phản ứng trùng ngưng theo luồng thông tin có sẵn đến chính là quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân tử bự (polime) bên cạnh đó giải phóng đa số phân tử nhỏ khác.
Điều khiếu nại cần: Monome có tối thiểu 2 nhóm chức có tác dụng phản ứng.
Một số làm phản ứng pha trộn thường gặp
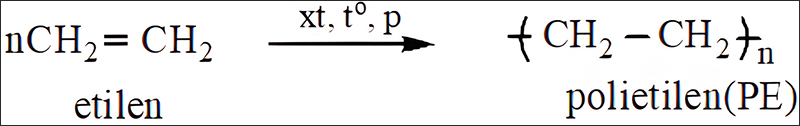
Nhựa PE
Nhựa PVC
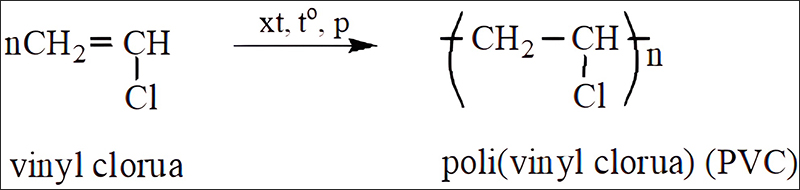
Nhựa PS
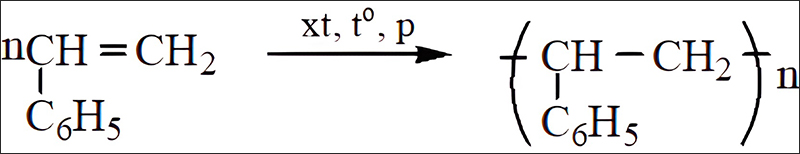
Tổng hợp kỹ năng và kiến thức hóa học 12: Đại cương cứng về kim loại
Trong chương trình hóa học 12, để ráng vững lý thuyết hóa 12 siêng đề Đại cưng cửng về kim loại, các bạn cần nắm vững những kiến thức và kỹ năng dưới đây:
Kim loại cũng như dãy năng lượng điện hóa của kim loại.Hợp kim cũng như sự làm mòn kim loại.Cách pha chế kim loại.Vị trí kim loại trong bảng tuần hoàn và kết cấu của kim loại
Vị trí của sắt kẽm kim loại trong bảng tuần hoànNhóm IA (trừ H), IIA, IIIA (trừ B), một phần nhóm IVA, VA,VIA.Các sắt kẽm kim loại nhóm B (từ nhóm IB cho VIIIB).Họ lantan và actini (2 hàng cuối vào BTH).Đặc điểm và cấu trúc của kim loại
Cấu tạo nguyên tử: Ít e lớp ngoài cùng (1 cho 3e), nửa đường kính nguyên tử kha khá lớn so với phi kim
Cấu tạo tinh thể: trong mạng tinh thể Kim loại có nguyên tử kim loại, Ion kim loại ở nút mạng và những electron tự do.
Liên kết kim loại: link được sinh ra giữa những nguyên tử kim loại và ion kim loại do sự tham gia của các electron tự do .
Chú ý: Mối quan hệ giữa cấu hình e và vị trí vào bảng tuần hoàn.
Số hiệu (Z = số e = số p) ↔ Ô (số lắp thêm tự).
Số lớp ↔ Chu kỳ.
Số e lớp ngoài cùng ↔ Số thứ tự nhóm (nhóm A) so với nguyên tố s,p ↔ Hóa trị cao nhất với oxi.
Tính hóa học của sắt kẽm kim loại – dãy điện hóa của kim loại
Tính hóa học vật lý của kim loạiTính chất vật lí phổ biến của kim loại: 4 tính chất = dẻo + dẫn điện + dẫn nhiệt + ánh kim.
Nguyên nhân: do e tự vị gây ra.
Tính hóa chất của kim loạiVới tính chất hóa học của kim loại, ta thấy như sau:
Tính khử = Nhường e = Bị oxi hóa
Nguyên nhân: Ít e lớp ngoài cùng + Bán kính lớn + Lực liên kết hạt nhân yếu.
Tác dụng với phi kim.
Tác dụng với axit.
Tác dụng cùng với HCl,H2SO4 loãng (kim loại trước H2) → Muối (Số OXH thấp) + H2
Tác dụng với hỗn hợp HNO3,H2SO4 đặc (tất cả kim loai trừ Au, Pt) → Muối (Số OXH cao) + Sp khử + nước
Chú ý: Al, Fe, Cr ko phản ứng với HNO3,H2SO4 đặc nguội.
Tác dụng với nước: Kim loại IA + IIA (trừ Be,Mg) + H2O
→ dd bazơ + H2
M(IA)+H2O→MOH+H2
M(Ca,Ba,Sr)+2H2O→M(OH)2+H2
Tác dụng với dd muối
Kim loại (không rã trong nước) đẩy được kim loại yếu rộng ra khỏi muối.
Kim loại (tan trong nước) thì ko đẩy được kim loại yếu ra khỏi muối mà xảy ra theo nhiều giai đoạn:
Phản ứng với nước → dd bazơ
Dung dịch bazơ phản ứng trao đổi với dd muối (nếu sau phản ứng có kết tủa)
Nếu kết tủa có tính lưỡng tính thì tiếp tục tan.
Tác dụng với dung dịch bazơ: Al, Zn rã được vào dung dịch bazơ.
Al+NaOH+H2O→Na
Al
O2+1,5H2Tìm hiểu hàng điện hóa của kim loại
Nguyên tắc sắp xếp: Từ trái sang phải trong dãy điện hóa của kim loại như sau:
Tính khử kim loại giảm dần.Tính oxi hóa ion kim loại cũng tăng dần.Ý nghĩa của dãy điện hóa kim loại: Giúp dự đoán chiều của làm phản ứng giữa 2 cặp oxi hóa – khử theo luật lệ alpha.
Sự ăn mòn kim loại
Sự làm mòn kim loại là sự việc phá hủy kim loại hoặc hợp kim do tác dụng các chất vào môi trường xung quanh.
Có 2 dạng nạp năng lượng mòn kim loại: Ăn mòn hóa học và ăn mòn điện hóa
Ăn mòn hóa học là quá trình oxi hóa khử, e của kim loại chuyển trực tiếp đến các chất trong môi trườngĂn mòn điện hóa là quá trình oxi hóa khử, bởi tác dụng chất điện li tạo dòng e di chuyển từ cực âm đến cực dương.Điều kiện ăn uống mòn kim loại
Có 2 điện cực khác chất (2 KL không giống nhau , KL-PK , KL- hòa hợp chất…).Khi 2 điện cực tiếp xúc với nhau (trực tiếp hoặc gián tiếp).Được đặt vào môi trường chất điện li (dung dịch; ko khí ẩm cũng là môi trường điện li).Cơ chế ăn mòn kim loại
Ta có: Cực âm (anot) = kim loại mạnh = quá trình oxi hóa = kim loại bị ăn mòn.
M→Mn++neCực dương(catot) = kim loại yếu (hoặc PK) = quá trình khử.
2H++2e→H2O2+2H2O+4e→4OH−Tóm lại: Nếu nạp năng lượng mòn điện hóa thì kim loại mạnh sẽ bị ăn mòn trước.
Có 2 cách chống ăn mòn:
Bảo vệ bề mặt: Bôi, sơn, mạ, tráng… bởi vật liệu bền với môi trườngPhương pháp điện hóa: Dùng kim loại hoạt động hơn để bảo vệ (kim loại hoạt động rộng sẽ bị ăn uống mòn trước)
Ví dụ: Vỏ tàu biển bằng thép được gắn vào các khối kẽm (khi kia Zn bị bào mòn điện hóa).
Phương pháp pha trộn kim loại
Trong phương thức điều chế kim loại, bạn cần xem xét như sau:Nguyên tắc pha trộn kim loạiKhử ion kim loại thành kim loại: Mn++ne→M (kim loại)
Phương pháp cụ thể như sau:
Nhiệt luyện:
Dùng chất khử mạnh (C,CO, H2, Al) để khử kim loại vào oxit (Từ Zn → Cu)
Ứng dụng: Điều chế kim loại hoạt động trung bình (Từ Zn → Cu)
Ví dụ : 4CO+Fe3O4→3Fe+4CO2
Thủy luyện:
Nguyên tắc: Dùng kim loại có tính khử mạnh khử ion của kim loại yếu hơn ra khỏi muối
Ứng dụng: Điều chế kim loại hoạt động trung bình và yếu
Điện phân:
Khử ion kim loại bằng dòng điện một chiều
Catot (cực âm ): xẩy ra quá trình khử = khử cation thu được kim loại
Anot (cực dương) : xảy ra quá trình oxi hóa thu được chất khí
Điện phân nóng chảy: Điều chế kim loại mạnh (IA, IIA, Al).
Điện phân dung dịch: Điều chế kim loại hoạt động trung bình hoặc yếu
Sơ đồ điện phân dung dịch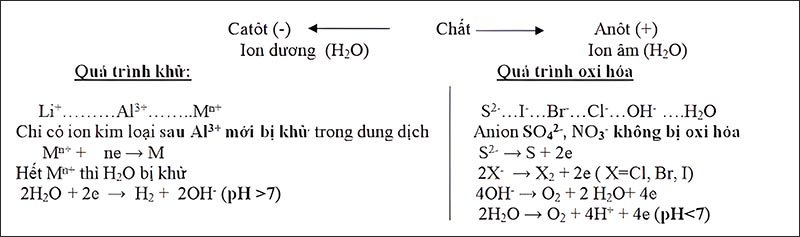
Tìm phát âm định luật Faraday
Định luật Faraday giúp tính khối lượng các chất thoát ra ở các điện cực: m = A.I.t / 96500.n
Trong đó:
m: Khối lượng chất thoát ra ở điện cựcA: Khối lượng mol nguyên tửn: Số e mang đến hoặc nhận
I: Cường độ dòng điện (Ampe)t: Thời gian điện phân (Giây)
Nhận biết một số chất khí trong dung dịch
Với kiến thức triết lý hóa 12, các bạn cần xem xét về bí quyết nhận biết một số trong những chất khí như sau:
Khí CO
Thuốc thử: hỗn hợp PdCl2Hiện tượng: hỗn hợp bị sẫm màu, gồm khí thoát ra.Phương trình bội nghịch ứng: CO+H2O+Pd
Cl2→2HCl+CO2+Pd
Khí CO2
Thuốc thử: sử dụng dịch nước vôi trongHiện tượng xẩy ra là có tác dụng đục nước vôi trong kế tiếp dung dịch trở phải trong suốt.Phương trình bội phản ứng:CO2+Ca(OH)2→Ca
CO3+H2OCa
CO3+H2O+CO2→Ca(HCO3)2
Khí SO2
Khí SO2 thông thường sẽ có mùi hắc khó khăn ngửi, cạnh tranh ngưởi và làm phai màu hoa hồng.Thuốc thử: áp dụng dung dịch brom hoặc hỗn hợp thuốc tím.Hiện tượng: làm mất đi màu hỗn hợp nước Brom hoặc làm mất màu dung dịch thuốc tím.Phương trình phản nghịch ứng:Br2+2H2O+SO2→H2SO4+2HBr5SO2+2KMnO4+2H2O→2H2SO4+2Mn
SO4+K2SO4
Khí SO3
Thuốc thử: dung dịch BaCl2Hiện tượng: mở ra kết tủa trắng.Phương trình làm phản ứng: Ba
Cl2+H2O+SO3→2HCl+Ba
SO4
Khí NH3
Khí NH3 có mùi khai, tạo cho quỳ tím tẩm ướt hoá xanh.Thuốc thử: Axit HCl đặcHiện tượng: mở ra khói trắng
Phương trình phản bội ứng: HCl+NH3→NH4Cl
Khí Clo
Thuốc thử: sử dụng dung dịch KI + hồ nước tinh bộtHiện tượng: hỗn hợp từ white color chuyển thành màu xanh.Phương trình phản bội ứng: Cl2+KI→2KCl+I2
Khí H2S
Khí H2S bám mùi trứng thối.Thuốc thử: cần sử dụng dung dịch Pb(NO3)2Hiện tượng: sản phẩm tạo thành là PbS kết tủa color đen.Phương trình bội nghịch ứng: Pb(NO3)2+H2S→Pb
S+2HNO3
Khí HCl
Khí HCl làm giấy quỳ tẩm ướt hoá đỏ.Thuốc thử: dung dịch AgNO3Hiện tượng: thành phầm tạo thành kết tủa màu trắng của Ag
Cl.Phương trình làm phản ứng: Ag
NO3+HCl→Ag
Cl+HNO3
Khí NO (không màu)
Thuốc thử: ko khíHiện tượng: hoá gray clolor đỏ
Phương trình làm phản ứng: 2NO+O2→2NO2
Khí NO2
Thuốc thử: Quỳ tím ẩmHiện tượng: có tác dụng quỳ tím hóa đỏ
Hoặc có tác dụng lạnh màu nâu đỏ nhạt dần tiếp nối mất màu, khi hết có tác dụng lạnh lại mở ra màu nâu đỏ.Phương trình phản bội ứng: 2NO2→N2O4
Khí O3 (ozon)
Thuốc thử: dung dịch KI và hồ tinh bộtHiện tượng: chế tác thành hỗn hợp màu tím xanh
Phương trình phản nghịch ứng: O3+2KI+H2O→KOH+I2+O2
Khí O2
Thuốc thử: Than đỏHiện tượng: Than bùng cháy.Phương trình phản ứng: C+O2→CO2
Khí N2
Thuốc thử: Que diêm đỏHiện tượng: Khí N2 làm que diêm tắt.
Xem thêm: Cách dỗ người yêu hết giận thành công cho nam và nữ, gian nguoi yeu em coi het quan ao【copy_sodo66
Tóm tắt kim chỉ nan hóa 12: Hóa học với vấn đề trở nên tân tiến kinh tế
Một số chất gây nghiện bắt buộc lưu ý
Rượu, thuốc phiện, cần sa, nicotin, cafein, cocain, heroin, mocphin,…
Các khí gây ô nhiễm môi trường
CO,CO2,SO2,H2S,CFC,, bụi
Tác hại của các chất khí gây ô nhiễm môi trường:
Hiệu ứng nhà kínhSức khỏe
Sinh trưởng, phát triển động, thực vật
Phá tầng ozon, mưa axit (do SO2,NO2,…)
Sự ô nhiễm môi trường nước
Nguyên nhân gây độc hại môi trường nước
Tự nhiên: Mưa, gió bão lụt → kéo chất bẩnNhân tạo: Sinh hoạt, giao thông vận tải vận tải, thuốc trừ sâu
Các tác nhân gây ô nhiễm: ion kim loại nặng (Hg, Pb, Cu, Mn,…), anion NO3-, NO−3,PO3−4,SO2−4,…
Tác hại của việc ô nhiễm môi trường nước
Sự ô nhiễm môi ngôi trường nước đã làm ảnh hưởng lớn sự sinh trưởng, phát triển động thực vật.Bên cạnh đó, ô nhiễm và độc hại môi trường nước cũng làm ảnh hưởng trực tiếp tới sức mạnh của bé người.cdvhnghean.edu.vn.VN đang cùng các bạn tìm hiểu cụ thể về các kiến thức tổng hợp định hướng hóa 12. Hy vọng đã cung ứng cho bạn bài viết hữu ích giao hàng cho quy trình tìm hiểu tương tự như ôn thi thpt Quốc Gia. Trường hợp có bất kể câu hỏi hay thắc mắc gì liên quan đến chủ thể tóm tắt kim chỉ nan hóa 12, đừng quên để lại trong thừa nhận xét bên dưới nha. Chúc bạn luôn học tập cùng ôn thi thiệt tốt!