Hiđro gồm nguyên tử khối là 1,008. Hỏi tất cả bao nhiêu nguyên tử của đồng vị ( _1^2 extrmH)trong 1ml nước (cho rằng trong nước chỉ có đồng vị ( _1^2 extrmH) và ( _1^1 extrmH))? (Cho cân nặng riêng của nước là một trong g/ml).
Bạn đang xem: Giải bài tập hóa 10 sgk trang 14
Gọi % số nguyên tử đồng vị ( _1^2 extrmH) là a%:
=> % của nguyên tử đồng vị ( _1^1 extrmH) là (100-a)%
( dfrac1(100-a)+2a100) = 1,008 => a = 0,8
Vì D = 1 g/ml
=> trọng lượng của 1ml nước là 1 trong những gam.
( Phân tử khối_H_2O) = 16 + 1,008.2 = 18,016u
=> khối lượng mol của nước là 18,016 g/mol
Số mol của 1 gam nước là: (dfrac118,016 = 0,0555mol)
Số nguyên tử H tất cả trong 1ml H2O:
(2.0,0555.6,022.10^23 = 6,68442.10^22) nguyên tử
Số nguyên tử ( _1^2 extrmH) chiếm: (6,68442.10^22.dfrac0,8100 = 5,35.10^20) nguyên tử
Loigiaihay.com


Chia sẻ
Bình chọn:
4.6 trên 244 phiếu
Bài tiếp theo

Luyện bài xích Tập Trắc nghiệm Hóa lớp 10 - coi ngay
Báo lỗi - Góp ý
 |  |  |  |
 |  |  |  |
TẢI ứng dụng ĐỂ xem OFFLINE


× Báo lỗi góp ý
Vấn đề em gặp mặt phải là gì ?
Sai bao gồm tả
Giải khó khăn hiểu
Giải sai
Lỗi không giống
Hãy viết cụ thể giúp Loigiaihay.com
gửi góp ý Hủy vứt
× Báo lỗi
Cảm ơn các bạn đã sử dụng Loigiaihay.com. Đội ngũ cô giáo cần nâng cấp điều gì để các bạn cho nội dung bài viết này 5* vậy?
Vui lòng nhằm lại thông tin để ad có thể liên hệ với em nhé!
Họ với tên:
gửi Hủy vứt
Liên hệ chế độ







Đăng cam kết để nhận giải thuật hay cùng tài liệu miễn phí
Cho phép loigiaihay.com nhờ cất hộ các thông báo đến bạn để nhận ra các lời giải hay cũng giống như tài liệu miễn phí.
Với giải bài xích tập trang 14 Chuyên đề Hóa 10 trong bài bác 1: links hóa học với hình học tập phân tử sách Chuyên đề Hóa lớp 10 Cánh diều hay nhất, cụ thể sẽ giúp học sinh dễ ợt trả lời các câu hỏi & làm bài tập siêng đề Hóa 10 trang 14.
Giải bài xích tập trang 14 siêng đề Hóa 10 - Cánh diều
Bài tập 1 trang 14 siêng đề Hóa 10: Viết cách làm Lewis của CF4, C2H6, C2H4 cùng C2H2.
Trả lời:
- phương pháp Lewis của CF4
Bước 1: Tính toàn bô electron hóa trị (N1) của phân tử CF4.
C tất cả 4 electron hóa trị, F có 7 electron hóa trị. Vào phân tử CF4 có một nguyên tử C và 4 nguyên tử F. Vậy N1 = 1.4 + 4.7 = 32 electron
Bước 2: Vẽ form phân tử tạo bởi links đơn giữa các nguyên tử:
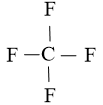
Số electron hóa trị đã dùng để xây dựng form là N2 = 4.2 = 8 electron
Số electron hóa trị sót lại là N3 = N1 – N2 = 32 – 8 = 24 electron
Bước 3: thực hiện 24 electron này để tạo ra octet cho F trước (vì F bao gồm độ âm điện cao hơn)
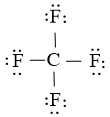
Bước 4: Nguyên tử C đã được octet. Vậy phương pháp Lewis của CF4 là
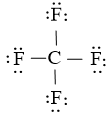
- Công thức Lewis của C2H6
Quảng cáo
Bước 1: Tính tổng thể electron hóa trị (N1) của phân tử C2H6.
C tất cả 4 electron hóa trị, H có 1 electron hóa trị. Trong phân tử C2H6 tất cả 2 nguyên tử C với 6 nguyên tử H. Vậy N1 = 2.4 + 6.1 = 14 electron
Bước 2: Vẽ form phân tử chế tạo ra bởi liên kết đơn giữa những nguyên tử:
Số electron hóa trị đã dùng để làm xây dựng form là N2 = 7.2 = 14 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 14 – 14 = 0 electron
Bước 3: Nguyên tử C cùng H rất nhiều đã được octet. Vậy công thức Lewis của C2H6 là
- Công thức Lewis của C2H4
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử C2H4:
C bao gồm 4 electron hóa trị, H có một electron hóa trị. Trong phân tử C2H4, bao gồm 2 nguyên tử C với 4 nguyên tử H. Vậy N1 = 2.4 + 4.1 = 12 electron
Bước 2: Vẽ size phân tử tạo bởi liên kết đơn giữa những nguyên tử.
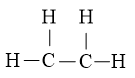
Số electron hóa trị đã dùng để xây dựng size là N2 = 5.2 = 10 electron
Số electron hóa trị sót lại là N3 = N1 – N2 = 12 – 10 = 2 electron
Bước 3: áp dụng N3 = 2 electron để tạo ra octet cho C trước
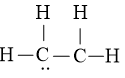
Bước 4: Đã thực hiện hết 2 electron để tạo octet cho C. Mặc dù C còn lại chưa đủ octet đề xuất ta chuyển 1 cặp electron của nguyên tử C vừa mới được tạo octet tạo ra thành cặp electron dùng chung giữa nhị nguyên tử C. Những nguyên tử H đã đủ octet. Vậy bí quyết Lewis của C2H4 là
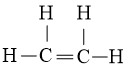
- Công thức lewis của C2H2
Bước 1: Tính toàn bô electron hóa trị (N1) của phân tử C2H2:
C tất cả 4 electron hóa trị, H có 1 electron hóa trị. Trong phân tử C2H2, có 2 nguyên tử C với 2 nguyên tử H. Vậy N1 = 2.4 + 2.1 = 10 electron
Bước 2: Vẽ form phân tử chế tạo ra bởi liên kết đơn giữa các nguyên tử:
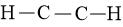
Số electron hóa trị đã dùng để làm xây dựng khung là N2 = 3.2 = 6 electron
Số electron hóa trị sót lại là N3 = N1 – N2 = 10 – 6 = 4 electron
Bước 3: sử dụng N3 = 4 electron để chế tạo octet cho một C trước
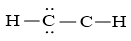
Bước 4: Đã thực hiện hết 4 electron để chế tạo ra octet cho 1 C. Tuy vậy C sót lại chưa đủ octet yêu cầu ta đưa 2 cặp electron của nguyên tử C vừa được tạo octet tạo ra thành cặp electron dùng phổ biến giữa hai nguyên tử C. Những nguyên tử H đã làm được octet.
Vậy phương pháp Lewis của C2H2 là
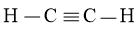
Bài tập 2 trang 14 siêng đề Hóa 10: Viết phương pháp Lewis của H2O. Dự kiến dạng hình học tập phân tử với dạng lai hóa của nguyên tử trung tâm.
Trả lời:
- cách làm Lewis của H2O
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử H2O:
O bao gồm 6 electron hóa trị, H có 1 electron hóa trị. Trong phân tử H2O, bao gồm 2 nguyên tử H và 1 nguyên tử O. Vậy N1 = 2.1 + 1.6 = 8 electron
Bước 2: Vẽ form phân tử tạo nên bởi liên kết đơn giữa các nguyên tử:
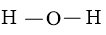
Số electron hóa trị đã dùng để làm xây dựng khung là N2 = 2.2 = 4 electron
Số electron hóa trị còn sót lại là N3 = N1 – N2 = 8 – 4 = 4 electron
Bước 3: áp dụng N3 = 4 electron để chế tác octet cho O. Các nguyên tử H đã có được octet.
Công thức Lewis của H2O là
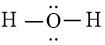
- dự kiến hình dạng phân tử với dạng lai hóa của nguyên tử trung trung ương O
Xung xung quanh nguyên tử trung trung khu O có 4 đám mây E (hai cặp electron chưa link và hai cặp electron chung), vị lực đẩy giữa các đám mây yêu cầu 4 đám mây E này phải có vị trí xa nhau nhất &r
Arr; 4 đám mây nhắm tới 4 đỉnh của một hình tứ diện đều.
&r
Arr; dự đoán phân tử nước có kết cấu góc (góc link 109,5o); nguyên tử trung trọng điểm O sinh hoạt dạng lai hóa sp3:
1 AO 2s tổ hợp với 3 AO 2p chế tác 4 AO lai hóa sp3
2 AO lai hóa sp3 đựng electron lẻ loi của nguyên tử O xen tủ với 2 AO s của nguyên tử H tạo thành 2 link σ.
Chú ý:
Do cặp electron chưa links chiếm khoảng không gian lớn hơn so với các cặp electron liên kết, shop đẩy giữa các cặp electron không liên kết lớn hơn tương tác đẩy giữa các cặp electron liên kết, đề xuất góc link HOH^thực tế bởi 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o).
Bài tập 3 trang 14 chuyên đề Hóa 10: Dựa theo bí quyết Lewis của CHCl3 xác định được dạng lai hóa của nguyên tử trung vai trung phong C trong phân tử này là
A. Sp B. Sp2 C. Sp3
Trả lời:
Đáp án đúng là: C
Công thức Lewis của CHCl3 là
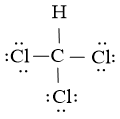
Nguyên tử trung chổ chính giữa C bao gồm 4 liên kết đơn xung quanh tương xứng với 4 đám mây electron. Bí quyết VSEPR của CHCl3 là AE4
Do 4 đám mây hướng về 4 đỉnh của một tứ diện nên bản thiết kế học không khí của CHCl3 bao gồm dạng tứ diện
&r
Arr; tâm trạng lai hóa của nguyên tử C vào phân tử CHCl3 là sp3.
Bài tập 4* trang 14 chuyên đề Hóa 10: Xác định phương pháp Lewis của nitric acid (HNO3). Cho biết nguyên tử H link với O mà chưa phải với N.
Trả lời:
Bước 1: Tính toàn bô electron hóa trị (N1) của phân tử HNO3:
N bao gồm 5 electron hóa trị, O gồm 6 electron hóa trị, H có một electron hóa trị. Vào phân tử HNO3, có một nguyên tử H, 3 nguyên tử O và 1 nguyên tử N
&r
Arr; toàn bô electron hóa trị N1 = 1.1 + 3.6 + 1.5 = 24 electron
Bước 2: Vẽ size phân tử chế tạo ra bởi liên kết đơn giữa các nguyên tử:
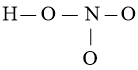
Số electron hóa trị đã dùng để làm xây dựng khung là N2 = 4.2 = 8 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 8 = 16 electron
Bước 3: sử dụng N3 = 16 electron để chế tạo ra octet mang lại O trước
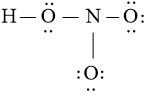
Bước 4: Đã áp dụng hết 16 electron để tạo thành octet mang lại O. Tuy vậy N chưa đủ octet cần ta đưa 1 cặp electron của nguyên tử O (không links với H) tạo thành thành cặp electron dùng tầm thường cho nhị nguyên tử O và N

Bài tập 5* trang 14 chuyên đề Hóa 10: Viết phương pháp Lewis và xác minh dạng hình học của CS2. Xác định dạng lai hóa của nguyên tử trung vai trung phong C vào phân tử này.
Xem thêm: Tổng hợp 8+ cách làm bài trình chiếu powerpoint 2003 mới nhất
Trả lời:
Công thức Lewis của CS2
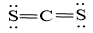
Xung xung quanh nguyên tử C gồm hai đám mây electron hóa trị, bởi lực đẩy thân 2 đám mây electron đề nghị 2 đám mây này đề xuất xa nhau độc nhất → CS2 gồm dạng đường thẳng theo quy mô VSEPR.
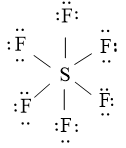
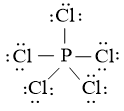
Bài tập 6* trang 14 chăm đề Hóa 10: Viết công thức Lewis của PCl5 với SF6
Trả lời:
Công thức Lewis của PCl5:
Công thức Lewis của SF6: