Bảng tính tung là trong những kiến thức cơ bạn dạng của môn hóa học nhưng mà lại hết sức quan trọng. Do bảng tính tan giúp cho bạn nhận biết được tính tan các chất trong nước như chất nào tan được vào nước, hóa học nào ko tan trong nước, hóa học nào ít tan trong nước, hóa học nào dễ dàng phân hủy, cất cánh hơi …Từ kia ta hoàn toàn có thể làm các bài phân biệt và các bài toán có kỹ năng và kiến thức liên quan.
Bạn đang xem: Bảng tính tan hóa học 11
Độ chảy của một chất trong nước
Bảng tính tan trong nước của các axit – muối – bazơ
Cách học tập thuộc bảng tính tan nhanh chóng1. Phép tắc rút gọn về tính chất tan
Chất tan và chất không tan
Ở trong nước có chất rã và chất không tan, có chất tung ít, có chất chảy nhiều.Tính tan của một số axit, bazo, muối
Bảng tính chảy của Axit: Hầu hết axit rã được trong nước, trừ axit silixic.Bảng tính tung của Bazo: phần lớn các bazo không tan trong nước, trừ một số như: KOH, NaOH,..Bảng tính rã của Muối: Những muối natri, kali đều tan; muối nitrat đều tan. Phần lớn các muối clorua, sunfat chảy được. Nhưng phần lớn các muối cacbonat không tan.
Độ tung của một chất trong nước
1. Độ chảy là gì?
Độ tan (kí hiệu là S) của một vào nước là số gam chất đó hòa tung trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
2. Yếu tố ảnh hưởng đến độ tan
Độ tung của chất rắn vào nước phụ thuộc vào nhiệt độ, vào nhiều trường hợp, lúc nhiệt độ tăng thì độ rã cũng tăng theo. Số ít trường hợp, nhiệt độ tăng độ tung lại giảm.
Độ tan của chất khí trong nước phụ thuộc vào nhiệt độ và áp suất. Độ tung của chất khí trong nước sẽ tăng, nếu ta giảm nhiệt độ và tăng áp suất
Bảng tính tan của những chất
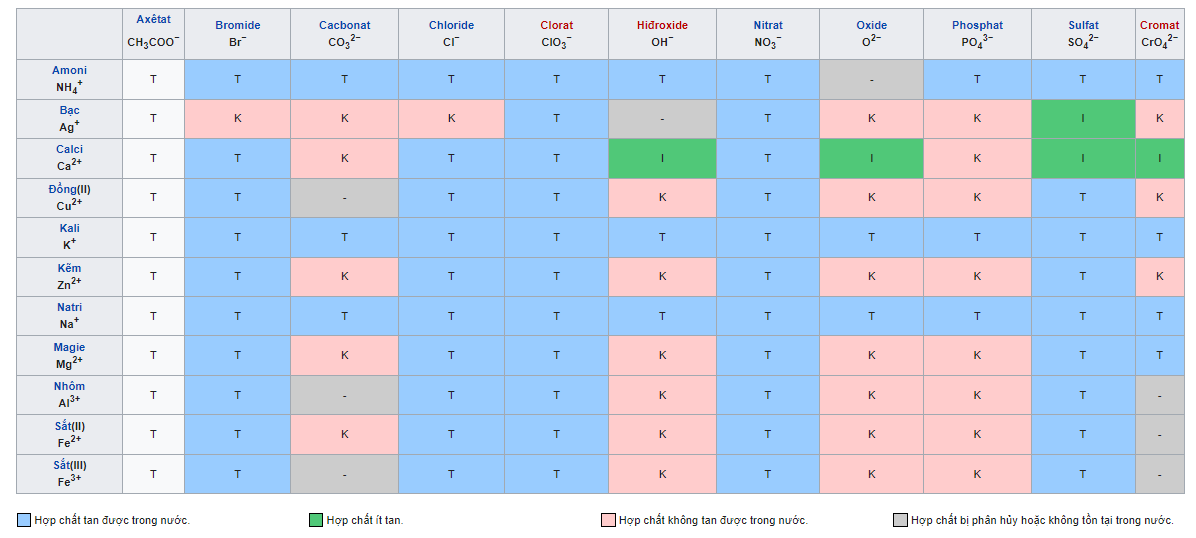
Bảng tính tung trong nước của những axit – muối hạt – bazơ
Chú thích:
T: hóa học dễ tanI: chất ít tan
K: chất không chảy (ô màu xanh)B: chất bay hơi– : chất không vĩnh cửu hoặc bị nước phân huỷ
Cách gọi bảng tính tan
Bảng tính rã gồm những hàng và các cột. Cột là những cation kim loại, còn sản phẩm là các anion gốc axit (hay OH-). Với một chất cố thể, ta sẽ xác định ion dương cùng ion âm, gióng theo hàng và cột tương xứng ta sẽ biết được trạng thái của hóa học đó trên một ô.
Đặc tính tung trong nước của Axit, Bazơ với muối
Các hợp chất khác biệt có công năng tan không giống nhau, tổng hòa hợp chung hoàn toàn có thể rút ra như sau:
Axit: phần nhiều các axit hầu hết tan trong nước, trừ Axit SilicicO3, H4Si
O4,…Bazơ: các bazơ số đông không thể rã trong nước trừ một số trong những hợp hóa học như : KOH, Na
OH…Muối: muối kali, natri đông đảo tan; muối bột nitrat mọi tan; số đông muối clorua, sunfat đầy đủ tan được nhưng hầu hết các muối cacbonat các không tan.
Màu sắc của một số trong những bazơ không tan tuyệt gặp.

Fe(OH)2: kết tủa lục nhạt
Fe(OH)3: kết tủa nâu đỏ
Mg(OH)2: kết tủa trắng không tan vào kiềm dư
Al(OH)3, Zn(OH)2, Pb(OH)2, Sn(OH)2: kết tủa trắng tung trong kiềm dư.
Cách học tập thuộc bảng tính tan cấp tốc chóng
Trong quá trình học hoá, các bạn cần thực hành thực tế và có tác dụng nhiều bài tập để rất có thể dễ dàng lưu giữ về tài năng hòa tan cũng tương tự điều kiện hoà tan của những hợp chất. Điều này sẽ giúp các bạn có thể hiểu sâu thêm về bản chất của các phản ứng hoá học tập và thuận lợi nhớ được độ tan của các chất thường gặp mặt trong bảng tính tan.
Tuy nhiên, việc học thuộc bảng tính tan vừa đủ sẽ không hẳn là điều thuận lợi và tiếp tục bị nhầm lẫn. Dưới đấy là 1 số phương pháp, bí quyết học thuộc bảng tính tan nhanh chóng đã được nhiều bạn áp dụng thành công như sau:
1. Quy tắc rút gọn về tính chất tan
Như đã chia sẻ ở trên về khả năng tan của muối, axit, bazo vào nước. Các bạn cũng có thể dựa vào những đặc điểm đó để ghi nhớ tính chất tan của các hoạt chất này trong nước. Cụ thể như sau:
a. Đối với muối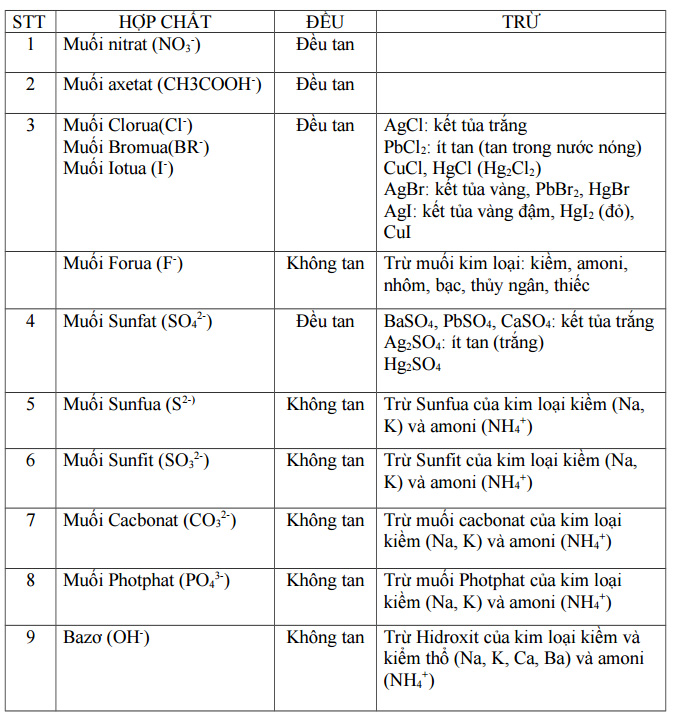
Các muối hạt tan và không tung được tổng hợp cụ thể và thiết yếu xác. Tính rã của muối hạt như sau:
Muối tất cả gốc halogen như -Cl, -Br, -F… phần lớn đều có chức năng tan trong nước.Muối gốc Silicat (SiO3), Sunfit (SO3), Cacbonat (CO3) giỏi Sunfua (S) đều sẽ không còn tan hoặc khó khăn tan vào nước.Tuy nhiên, lưu ý rằng khi các gốc này kết hợp với kim loại bao gồm tính kiềm sẽ tạo ra những hợp chất muối rã được vào nước.Nhìn chung, các kim loại kiềm như K, Na, Li… sau khi phối hợp thành muối hạt đều rất có thể tan vào nước. Các chúng ta cũng có thể thấy vấn đề đó khi nhìn những hàng bao gồm chưa sắt kẽm kim loại tính kiềm, nó số đông được ký kết hiệu bằng chữ T, tức là các chất dễ tan.Muối nơi bắt đầu Sunfat (SO4) hầu như đều rã trong nước với trừ muối bột sunfat của kim loại bari ko tan.
Lưu ý: Có một số trong những muối ko tồn tại hoặc nó hoàn toàn có thể bị phân huỷ ngay lập tức trong nước, được ký hiệu bằng dấu “-“ vào bảng tính tan. Phần lớn trường hòa hợp này, không có tương đối nhiều nên các bạn nhớ lưu lại vào để học nha.
b. Đối cùng với axit và bazoĐa phần các axit đều tan thuận tiện trong nước. Chỉ riêng H2CO3 thì tiện lợi bị phân huỷ nội địa và các axit gồm gốc silicic như H2SiO3, H4Si
O4… thì không tan.Còn với các bazo thì phần lớn không rã trong nước. Riêng rẽ với bazo của sắt kẽm kim loại kiềm như Li, K, N phần đông tan nội địa và các bazo của kim loại nhóm 2 đã ít tan trong nước.
2. Mẹo học thuộc bảng tính tung qua thơ
Bazơ, phần lớn chú ko tan:Đồng, nhôm, crôm, kẽm, mangan, sắt, chìÍt tung là của canxi
Magie cũng chẳng năng lượng điện li dễ dàng.
Muối sắt kẽm kim loại kiềm đầy đủ tan
Cũng như nitrat và “nàng” hữu cơ
Muốn nhớ thì đề nghị làm thơ!Ta làm thí nghiệm hiện thời thử coi,
Kim koại I (IA), ta biết rồi,Những sắt kẽm kim loại khác ta “moi” ra tìm
Photphat vào nước đứng yên (trừ kim loại IA)Sunfat một vài “im lìm trơ trơ”:Bari, chì với S-rÍt tan bao gồm bạc, “chàng khờ” canxi,
Còn muối clorua thì
Bạc đành kết tủa, anh chì nạm tan (giống Br- với I-)
Muối không giống thì nhớ dễ dàng:Gốc SO3 chẳng tung chút nào! (trừ kim loại IA)Thế cội S thì sao? (giống muối CO32-)Nhôm ko tồn tại, chú nào cũng tan
Trừ đồng, thiếc, bạc, mangan, thuỷ ngân, kẽm, sắt không tan cùng chì
Hy vọng cùng với những thông tin về bảng tính tan chất hóa học mà cửa hàng chúng tôi vừa chia sẻ cụ thể phía trên có thể giúp chúng ta hệ thống lại kỹ năng và kiến thức môn hóa của chính mình từ đó vận dụng vào làm những bài tập nhé
Home » top 7+ bảng tính rã hóa học tiên tiến nhất » Bảng tính tan hóa học 11 vừa đủ và biện pháp học thuộc đối kháng giản
Bảng tính tung là phần văn bản kiến thức luôn luôn phải có trong cỗ môn chất hóa học 11. Trải qua bảng tính tan bạn có thể nhận biết được xem tan các chất vào nước, chất kết tủa, chất cất cánh hơi….
Với lượng tin tức lớn như vậy sẽ khá khó ghi ghi nhớ đối với chúng ta học sinh. Vậy hãy theo dõi bài viết dưới phía trên của cửa hàng chúng tôi để vậy chắc được kỹ năng và kiến thức và cách ghi nhớ bảng tính tan tác dụng nhé!
Nội dung chính:
Định nghĩa về độ hòa tan
Độ hòa tan giỏi độ tan cho biết thêm khả năng tổng hợp một hóa học trong dung môi để tạo thành thành một chất bão hòa trong ánh nắng mặt trời nước.Để xác minh được chất tan hay không không tan hoàn toàn có thể dựa vào tin tức sau:
Nếu mang trên 10g hóa học đố rất có thể hòa rã được trong 100g nước tổng hợp thì chát này được call là chất tan hay chất dễ tan.Nếu chỉ bên dưới 1g chất đó được hòa tung trong 100g nước thì chất đó được gọi là chất ít tan.Nếu chỉ 0,01g chất này được hòa tung trong 100g nước phối hợp thì chất đó được gọi là chất không tan.Bảng tính tan chất hóa học 11 đầy đủ
Dưới đây là bảng tính tan hóa học 11 khá đầy đủ bạn nên tham khảo
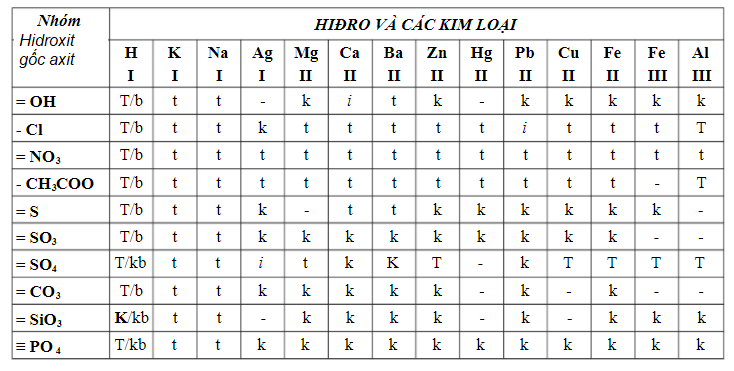
Ghi chú:
T: chất dễ tanI: chất ít tan
K: chất không tan
B: chất cất cánh hơi-: hóa học không sống thọ hoặc bị nước phân hủy
Cách hiểu bảng tính tan:
Bảng tính tan bao hàm các cột mặt hàng hàng ngang cùng hàng cột dọc. Trong số đó cột dọc là các cation kim loại, còn sản phẩm là những anion cội axit. Trải qua bảng tính tan, chúng ta có thể xác định được ion dương cùng ion âm gióng theo hàng cùng cột khớp ứng để hiểu rằng trạng thái của chất đó trên một ô.
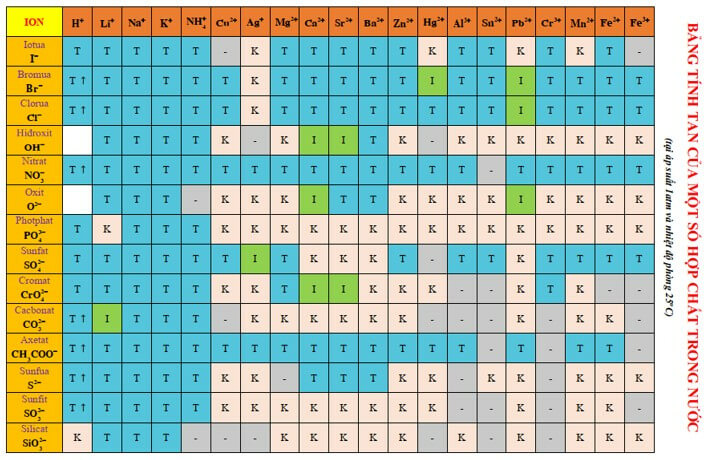
Bảng tính rã Hóa Học
Các yếu hèn tố ảnh hưởng đến độ rã của một chất
Tính chảy của một chất được tác động bởi các yếu tố khác nhau, ví dụ là những yếu tố tác động đến độ tan của một chất như sau:
1. Nhiệt độ
Đối với chất khí, độ tan của chất sẽ tỷ lệ nghịch với ánh sáng trong dung môi.Chất rắn thu nhiệt thì khi nhiệt độ càng cao sẽ khiến độ tổng hợp của của hóa học đố càng lớn.Chất rắn tỏa nhiệt độ khi ánh sáng càng sút thì độ hòa tan của hóa học càng tăng.2. Áp suất
Các hóa học khí gồm độ tan bé dại và áp suất không thực sự cao thì lúc tăng áp suất bề mặt chất lỏng ko đổi, thì lượng chất khí hòa tan trong một thể tích chất lỏng đang tăng với ngược lại.
3. Độ phân rất của chất tan và dung môi
Các hóa học phân rất sẽ thường rất dễ tan rộng trong môi trường thiên nhiên dung môi phân cực. Lấy ví dụ như: kiềm, nước, dung dịch muối/axit vô cơ,….Chất ít phân cực sẽ dễ tan trong môi trường dung môi hữu cơ yếu phân cực. Ví dụ như: benzene, chloroform, dichloromethane,….4. Hình trạng thù
Thông thường những loại hóa học rắn dạng vô định hình sẽ có độ tan to hơn so với chất rắn dạng tinh thể trong 1 môi trường xung quanh dung môi. Ngược lại, chất rắn dưới dạng vô đánh giá sẽ không ổn định như dạng tinh thể.
5. Hiện tượng hydrat hóa
Trong quy trình kết tinh hóa học rắn thường có thể tồn trên được 2 dạng: dạng ngậm nước hoặc dạng khan. Đối với dạng ngậm nước hóa học ở dạng khan sẽ có tính tan bự hơn.
6. Độ p
H của dung dịch
Nếu axit hóa dung môi, độ rã của chất kiềm yếu sẽ tăng lên.Khi kiềm hóa dung môi, chất axit yếu sẽ có được độ rã tăng lên.Những chất lưỡng tính, độ tan của các chất sẽ sút dần lúc độ pH càng ngay gần với điểm đẳng điện với ngược lại.
7. Hóa học điện ly
Độ tan của những chất có thể bị giảm đi trong dung môi gồm chất ddiejn ly, vậy nên trước lúc hòa vào dung dịch chúng ta cần chú ý pha loãng chất điện ly.
8. Hỗn hợp dung môi
Khi phối kết hợp các tất cả hổn hợp dung môi đồng tan cùng rất nước đã làm tăng độ tan của rất nhiều chất nặng nề tan. Ví dụ: glycerin- ethanol-nước.
Cách ghi nhớ bảng tính tan
Bảng tính tan bao gồm khá những thông tin, cạnh tranh ghi nhớ. Hãy đọc cách ghi nhớ bảng tính tan hóa học 11 kết quả dưới phía trên được chúng tôi chia sẻ dưới đây:
| Hợp chất | Tính chất | Trừ |
| Axit (ở cột ion H+ và anion nơi bắt đầu axit tương ứng) | Đều tan | H2Si O3 |
| Bazo (hàng ion OH- với cation tương ứng) | Không tan | Li OH, Na OH, KOH, Ba(OH)2, Ca(OH)2, NH4OH. |
| Muối liti- Li+ Muối natri-Na+ Muối Kali-K+ Muối amoni-NH4+ | Đều tan | |
| Muối bạc-Ag+ | Không tan | Ag NO3, CH3COOAg |
| Muối nitrat NO3- Muối axetat CH3COO- | Đều tan | |
| Muối clorua Cl- Muối bromua Br- Muối iotua I- | Đều tan | Ag CL: tạo thành kết tủa tắng Ag Ag Pb |
| Muối sunfat SO4 2- | Đều tan | Ba SO4, Ca SO4, Pb SO4: kết tủa trắng Ag2SO4: không nhiều tan |
| Muối Sunfit SO3 2- | Không tan | muối với kim loại kiềm cùng NH4+ |
| Muối sunfua S2- | Không tan | muối với kim loại kiềm, kiềm thổ và NH4+ |
| Muối photphat PO4 3- | Không tan | muối với mãng cầu +, K+, NH4+ |
Tổng kết
Trên đây là toàn cục nội dung tìm hiểu về bảng tính tan chất hóa học 11 đầy đủ, phương pháp dễ ghi ghi nhớ bảng tính tan. Mong muốn những tin tức hữu ích của nội dung bài viết sẽ khiến cho bạn đọc học tập tác dụng hơn. Để có thêm những thông tin bổ ích khác, hãy truy vấn vào website của chúng tôi nhé.
Xem thêm: Ba mét phía trên bầu trời (phần 3 mét phía trên bầu trời (phần 3)
Bạn đang xem bài xích viết: Bảng tính tan hóa học 11 không thiếu và biện pháp học thuộc 1-1 giản. Tin tức được tạo vị Trung chổ chính giữa Tiêng Anh cdvhnghean.edu.vn tinh lọc và tổng hợp cùng với những chủ đề liên quan khác.